Elektroner oppfører seg som bølger
Fysikere har lenge visst at lys er en elektromagnetisk bølge. Til i dag er det ingen som tviler på denne posisjonen, siden lys tydelig viser alle tegn på bølgeadferd: lysbølger kan overlappe hverandre, generere et interferensmønster, de er også i stand til å skille seg, bøye seg rundt hindringer langs diffraksjonstiden.
Når vi ser en fugl som går som en and, svømmer som en and og kvakker som en and, kaller vi den fuglen en and. Så lyset er elektromagnetisk bølgebasert på objektivt observerte tegn på oppførselen til en slik bølge i lys.

Men på slutten av 1800- og 1900-tallet skulle fysikere begynne å snakke om lysets «partikkelbølgedualisme». Det viser seg at kunnskapen om at lys er en elektromagnetisk bølge ikke er alt vitenskapen vet om lys. Forskere har oppdaget en veldig interessant funksjon i lys.
Det viser seg at lys på en eller annen måte manifesterer seg SOM oppførselen til en strøm av partikler på en eller annen måte.Det ble funnet at energien som bæres av lyset, etter å ha blitt talt over en viss tid av en spesiell detektor, viser seg å være sammensatt uansett av individuelle (hele) deler.
Derfor ble det sant at lysets energi er diskret, fordi den så å si er sammensatt av individuelle partikler - "kvanter", det vil si av de minste hele deler av energi. En slik partikkel av lys, som bærer en enhet (eller kvante) av energi, ble kalt et foton.
Energien til ett foton er funnet ved følgende formel:
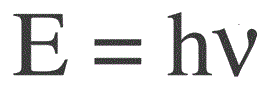
E — fotonenergi, h — Plancks konstant, v — frekvens.
Den tyske fysikeren Max Planck etablerte først eksperimentelt faktumet om lysbølgens diskrethet og beregnet verdien av konstanten h, som vises i formelen for å finne energien til individuelle fotoner. Denne verdien viste seg å være: 6.626 * 10-34 J * s. Planck publiserte resultatene av arbeidet sitt på slutten av 1900-tallet.

Tenk for eksempel på en lilla stråle. Frekvensen til slikt lys (f eller v) er 7,5 * 1014 Hz Plancks konstant (h) er 6,626 * 10-34 J * s. Dette betyr at energien til fotonet, (E), karakteristisk for fargen fiolett, er 5 * 10-19 J. Dette er en så liten del av energien at den er svært vanskelig å fange.
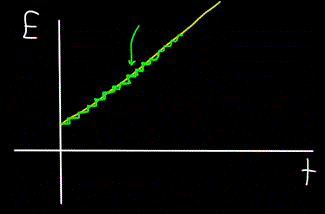
Se for deg en fjellbekk - den renner som én enhet, og det er umulig å se med det blotte øye at bekken faktisk består av individuelle vannmolekyler. I dag vet vi imidlertid at det makroskopiske objektet – flyt – faktisk er diskret, det vil si at det består av individuelle molekyler.
Dette betyr at hvis vi kan plassere en molekylteller ved siden av strømmen for å telle vannmolekylene som passerer mens strømmen renner, vil detektoren alltid bare telle hele antall vannmolekyler, ikke delvise.
Tilsvarende vil grafen over den totale energien til fotonet E, beregnet på tidspunktet t — alltid vise seg å ikke være lineær (gul figur), men trinnvis (grønn figur):
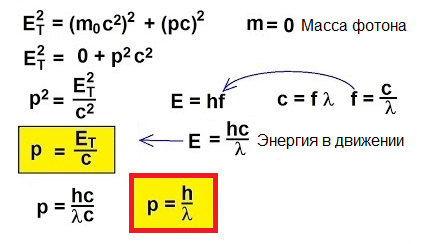
Så fotoner beveger seg, de bærer energi, derfor har de momentum. Men et foton har ingen masse. Hvordan kan du da finne fremdrift?
Faktisk, for objekter som beveger seg med hastigheter nær lysets hastighet, er den klassiske formelen p = mv rett og slett ubrukelig. For å forstå hvordan du finner momentum i dette uvanlige tilfellet, la oss gå til spesiell relativitet:
I 1905 forklarte Albert Einstein fra dette synspunktet fotoelektrisk effekt… Vi vet at metallplaten har elektroner inni seg, som inni seg tiltrekkes av de positivt ladede kjernene til atomene og derfor holdes tilbake i metallet. Men hvis du skinner en slik plate med lys av en BESTEMT frekvens, så kan du slå elektroner ut av platen.
Det er som om lys oppfører seg som en strøm av partikler med momentum.Og selv om et foton ikke har noen masse, samhandler det likevel på en eller annen måte med et elektron i et metall, og under visse forhold er et foton i stand til å slå ut et elektron.
Så hvis et foton som faller inn på platen har nok energi, vil elektronet slås ut av metallet og bevege seg ut av platen med hastighet v. Et slikt utslått elektron kalles et fotoelektron.
Siden det utslåtte elektronet har en kjent masse m, vil det ha en viss kinetisk energi mv.
Energien til fotonet, når det virket på metallet, omdannes til energien til elektronets utgang fra metallet (arbeidsfunksjonen) og til den kinetiske energien til elektronet, som har som det utslåtte elektronet begynner å bevege seg ut av metallet og forlater det.
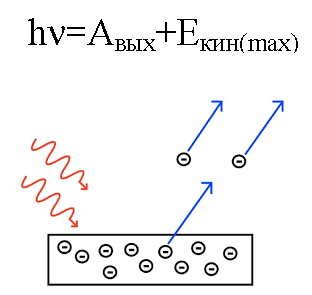
Anta at et foton med kjent bølgelengde treffer overflaten til et metall som arbeidsfunksjonen (til et elektron fra metallet) er kjent for. I dette tilfellet kan den kinetiske energien til et elektron som sendes ut fra et gitt metall lett bli funnet, så vel som dets hastighet.
Hvis energien til fotonet ikke er tilstrekkelig til at elektronet kan utføre arbeidsfunksjonen, kan elektronet ganske enkelt ikke forlate overflaten til det gitte metallet og fotoelektronet dannes ikke.
I 1924, en fransk fysiker Louis de Broglie legge frem en banebrytende idé i henhold til hvilken ikke bare fotoner av lys, men elektronene selv kan oppføre seg som bølger. Forskeren utledet til og med en formel for den hypotetiske bølgelengden til elektronet. Disse bølgene ble senere kalt "de Broglie-bølger".
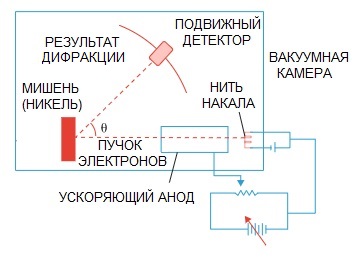
De Broglies hypotese ble senere bekreftet. Et fysikkeksperiment på elektrondiffraksjon, utført i 1927 av amerikanske forskere Clinton Davison og Lester Germer, påpekte til slutt elektronets bølgenatur.
Når en elektronstråle ble rettet gjennom en spesiell atomstruktur, ser det ut til at detektoren burde ha registrert bildet som partikler som flyr etter hverandre, noe som logisk sett ville vært forventet hvis elektroner var partikler.
Men i praksis har vi et bilde som er karakteristisk for bølgediffraksjon. Dessuten er lengdene på disse bølgene helt i samsvar med konseptet foreslått av de Broglie.
Til syvende og sist gjorde de Broglies idé det mulig å forklare prinsippet til Bohrs atommodell, og senere gjorde det det mulig for Erwin Schrödinger å generalisere disse ideene og legge grunnlaget for moderne kvantefysikk.
