Hvordan batterier fungerer og fungerer
 I den bredeste betydningen av ordet i teknologi, refererer begrepet "batteri" til en enhet som tillater under visse driftsforhold å akkumulere en viss type energi, og i andre å bruke den til menneskelige behov.
I den bredeste betydningen av ordet i teknologi, refererer begrepet "batteri" til en enhet som tillater under visse driftsforhold å akkumulere en viss type energi, og i andre å bruke den til menneskelige behov.
De brukes der det er nødvendig å samle energi i en viss tid og deretter bruke den til å gjennomføre store arbeidskrevende prosesser. For eksempel lar hydrauliske akkumulatorer brukt i sluser skip stige til et nytt nivå på elveleiet.
Elektriske batterier fungerer med elektrisitet etter samme prinsipp: først akkumulerer (akkumulerer) elektrisitet fra en ekstern ladekilde og gir den deretter til tilkoblede forbrukere for å utføre arbeid. Av natur tilhører de kjemiske strømkilder som er i stand til å utføre periodiske sykluser med utladning og lading gjentatte ganger.
Under drift skjer det konstant kjemiske reaksjoner mellom komponentene i elektrodeplatene med deres fyllstoff - elektrolytt.
Et skjematisk diagram av en batterienhet kan representeres av en forenklet tegning når to plater av forskjellige metaller med ledninger settes inn i karets kropp for å gi elektriske kontakter. En elektrolytt helles mellom platene.
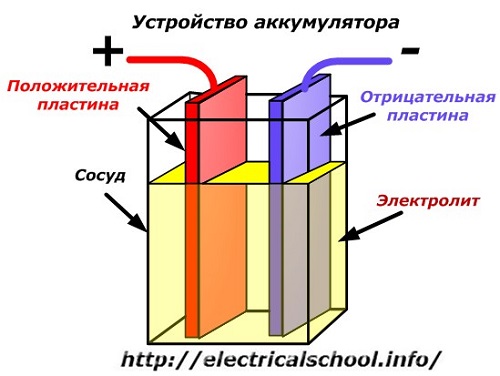
Batteridrift når utladet
Når en last, for eksempel en lyspære, kobles til elektrodene, dannes en lukket elektrisk krets som utladningsstrømmen flyter gjennom. Det dannes ved bevegelse av elektroner i metalldeler og anioner med kationer i elektrolytten.
Denne prosessen er konvensjonelt vist på et diagram med en nikkel-kadmium-elektrodedesign.
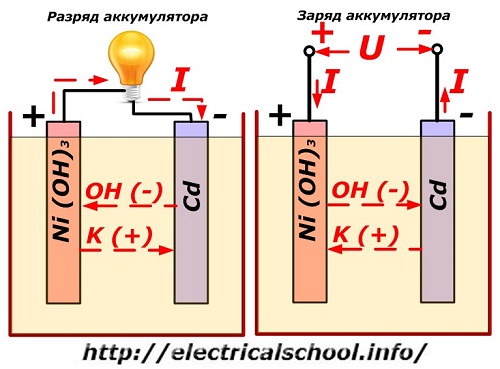
Her brukes nikkeloksider med grafitttilsetninger, som øker den elektriske ledningsevnen, som materialet til den positive elektroden. Metallet i den negative elektroden er svampaktig kadmium.
Under utladning frigjøres aktive oksygenpartikler fra nikkeloksider til elektrolytten og ledes til de negative platene, hvor kadmiumet oksideres.
Batteriytelse ved lading
Når lasten er slått av, påføres en konstant (i visse situasjoner, pulserende) spenning til plateterminalene med en større verdi enn for et ladet batteri med samme polaritet, når pluss- og minuspolene til kilden og forbrukeren faller sammen .
Laderen har alltid mer kraft, noe som "undertrykker" restenergien i batteriet og lager en elektrisk strøm i motsatt utladningsretning. Som et resultat endres de interne kjemiske prosessene mellom elektrodene og elektrolytten. For eksempel, på en boks med nikkel-kadmiumplater, er den positive elektroden beriket med oksygen, og den negative - til en tilstand av rent kadmium.
Når batteriet er utladet og ladet, endres den kjemiske sammensetningen av materialet til platene (elektrodene), men elektrolytten endres ikke.
Metoder for batteritilkobling
Parallellkobling
Hvor mye utladningsstrøm en person tåler avhenger av mange faktorer, men først og fremst utformingen, materialene som brukes og deres dimensjoner. Jo større arealet av platene ved elektrodene er, jo større strømmen tåler de.
Dette prinsippet brukes til å koble celler av samme type parallelt i batterier når det er nødvendig å øke strømmen til lasten.Men for å lade et slikt design vil det være nødvendig å øke kraften til kilden. Denne metoden brukes sjelden til ferdige strukturer, siden det nå er mye lettere å umiddelbart kjøpe det nødvendige batteriet. Men syrebatteriprodusenter bruker det, og kobler forskjellige plater til enkeltblokker.
Seriell tilkobling
Avhengig av materialene som brukes, kan det genereres en spenning på 1,2 / 1,5 eller 2,0 volt mellom de to elektrodeplatene til batterier som er vanlig i hverdagen. (Faktisk er dette området mye bredere.) Det er åpenbart ikke tilstrekkelig for mange elektriske enheter. Derfor kobles batterier av samme type i serie, og dette gjøres ofte i ett tilfelle.
Et eksempel på et slikt design er den utbredte bilutviklingen basert på svovelsyre og blyelektrodeplater.
Vanligvis, blant mennesker, spesielt blant transportsjåfører, er det vanlig å kalle enhver enhet et batteri, uavhengig av antall bestanddeler - bokser. Dette er imidlertid ikke helt riktig.Strukturen, satt sammen av flere bokser koblet i serie, er allerede et batteri, som det forkortede navnet «АКБ» er festet til... Dens interne struktur er vist i figuren.
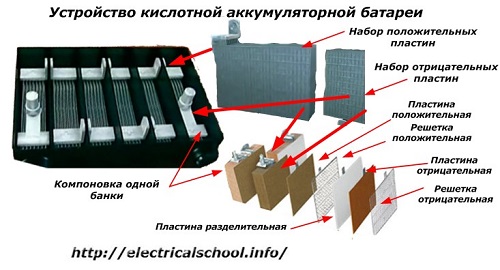
Hver av glassene består av to blokker med et sett med plater for de positive og negative elektrodene. Blokkene passer inn i hverandre uten metallkontakt med mulighet for en pålitelig galvanisk forbindelse gjennom elektrolytten.
I dette tilfellet har kontaktplatene et ekstra gitter og er adskilt fra hverandre med en skilleplate.
Å koble platene i blokker øker deres arbeidsområde, reduserer den totale motstanden til hele strukturen og lar deg øke kraften til den tilkoblede lasten.
På utsiden av esken har et slikt batteri elementene vist i figuren under.
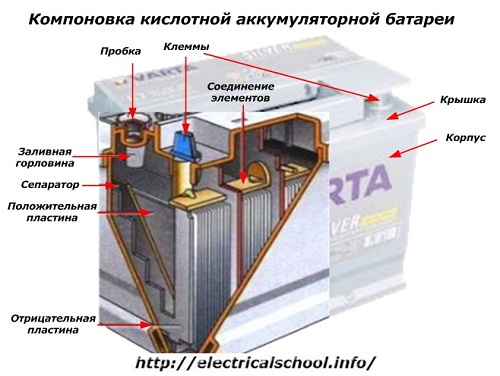
Den viser at det solide plasthuset er forseglet med et deksel og utstyrt med to terminaler (vanligvis kjegleformede) på toppen for tilkobling til bilens elektriske krets. Polaritetsmerker er stemplet på terminalene deres: «+» og «-«. Vanligvis har den positive terminalen en litt større diameter enn den negative terminalen for å blokkere ledningsfeil.
Batterier som kan repareres har et påfyllingshull på toppen av hver krukke for å kontrollere elektrolyttnivået eller tilsette destillert vann under drift. En plugg er skrudd inn i den, som beskytter de indre hulrommene i kassen mot forurensning og samtidig forhindrer at elektrolytten søles når batteriet vippes.
Siden med en kraftig ladning er gassing fra elektrolytten mulig (og denne prosessen er mulig under intensiv kjøring), er det laget hull i pluggene for å hindre at trykket inne i boksen øker.Oksygen og hydrogen, samt elektrolyttdamper, kommer ut gjennom dem. Det anbefales å unngå slike situasjoner som involverer for høye ladestrømmer.
Den samme figuren viser koblingen av elementene mellom bankene og arrangementet av elektrodeplatene.
Bilstartbatterier (blysyre) fungerer etter prinsippet om dobbel sulfatering. Under utladning / lading finner en elektrokjemisk prosess sted på dem, ledsaget av en endring i den kjemiske sammensetningen av den aktive massen av elektrodene med frigjøring / absorpsjon av vann i elektrolytten (svovelsyre).
Dette forklarer økningen i elektrolyttens egenvekt ved lading og reduksjonen når batteriet er utladet. Med andre ord lar tetthetsverdien deg vurdere den elektriske tilstanden til batteriet. En spesiell enhet brukes til å måle det - et bilhydrometer.
Destillert vann, som er en del av elektrolytten til syrebatterier, blir til en fast tilstand - is ved negative temperaturer. Derfor, for å forhindre at bilbatterier fryser i kaldt vær, er det nødvendig å bruke spesielle tiltak fastsatt i reglene for utnyttelse.
Hvilke typer batterier finnes det?
Moderne produksjon for ulike formål produserer mer enn tre dusin produkter med forskjellig sammensetning av elektroder og elektrolytt. 12 kjente modeller kjører kun på litium.

Følgende kan finnes som elektrodemetall:
-
lede;
-
jern;
-
litium;
-
titan;
-
kobolt;
-
kadmium;
-
nikkel;
-
sink;
-
sølv;
-
vanadium;
-
aluminium
-
noen andre gjenstander.
De påvirker de elektriske utgangsegenskapene og dermed applikasjonen.
Evnen til å motstå kortsiktige høye belastninger som følge av rotasjon av veivaksler til forbrenningsmotorer av elektriske startmotorer er karakteristisk for bly-syrebatterier. De er mye brukt i transport, avbruddsfri strømforsyning og nødstrømsystemer.
Standard galvaniske celler (vanlige batterier) erstattes vanligvis med nikkel-kadmium-, nikkel-sink- og nikkel-metallhydrid-batterier.
Men litium-ion- eller litium-polymer-design fungerer pålitelig i mobile enheter og dataenheter, konstruksjonsverktøy og til og med elektriske kjøretøy.
Avhengig av typen elektrolytt som brukes, er batteriene:
-
sur
-
alkalisk.
Det er en klassifisering av batterier etter formål. For eksempel, under moderne forhold, har det dukket opp enheter som brukes til energioverføring - lading av andre kilder. Det såkalte eksterne batteriet hjelper eierne av mange mobile enheter i fravær av et vekslende elektrisk nettverk. Den er i stand til å gjentatte ganger lade et nettbrett, smarttelefon, mobiltelefon.
Alle disse batteriene har samme driftsprinsipp og en lignende enhet. For eksempel gjentar litiumion-fingermodellen vist i figuren nedenfor på mange måter utformingen av syrebatteriene diskutert tidligere.
Her ser vi de samme kontaktelektrodene, plater, separator og hus. Bare de er laget under hensyntagen til andre arbeidsforhold.
Grunnleggende elektriske egenskaper til et batteri
Driften av enheten påvirkes av parametrene:
-
kapasitet;
-
energi tetthet;
-
selvutladning;
-
temperaturregime.
Kapasiteten kalles den maksimale ladningen til batteriet, som det er i stand til å gi under utlading til laveste spenning. Det uttrykkes i anheng (SI-system) og amperetimer (ikke-systemenhet).
Som en type kapasitet er det «energikapasitet», som bestemmer energien som frigjøres under utladningen til minimum tillatt spenning. Det måles i joule (SI) og watt-timer (ikke-SI-enheter).
Energitetthet uttrykt som forholdet mellom mengden energi og vekten eller volumet til batteriet.
Selvutlading vurdere tap av kapasitet etter lading i fravær av belastning på terminalene. Dette avhenger av designet og forverres av isolasjonsbrudd mellom elektrodene av mange årsaker.
Driftstemperaturen påvirker de elektriske egenskapene og i tilfelle alvorlige avvik fra normen spesifisert av produsenten, kan det skade batteriet. Varme og kulde er uakseptable, de påvirker forløpet av kjemiske reaksjoner og trykket fra miljøet inne i boksen.
